Surveillance Après Commercialisation (SAC/PMS), Suivi Clinique Après Commercialisation (SCAC/PMCF/PMPF) et Etudes de SCAC/PMCF/PMPF
16/11/2021

Surveillance Après Commercialisation
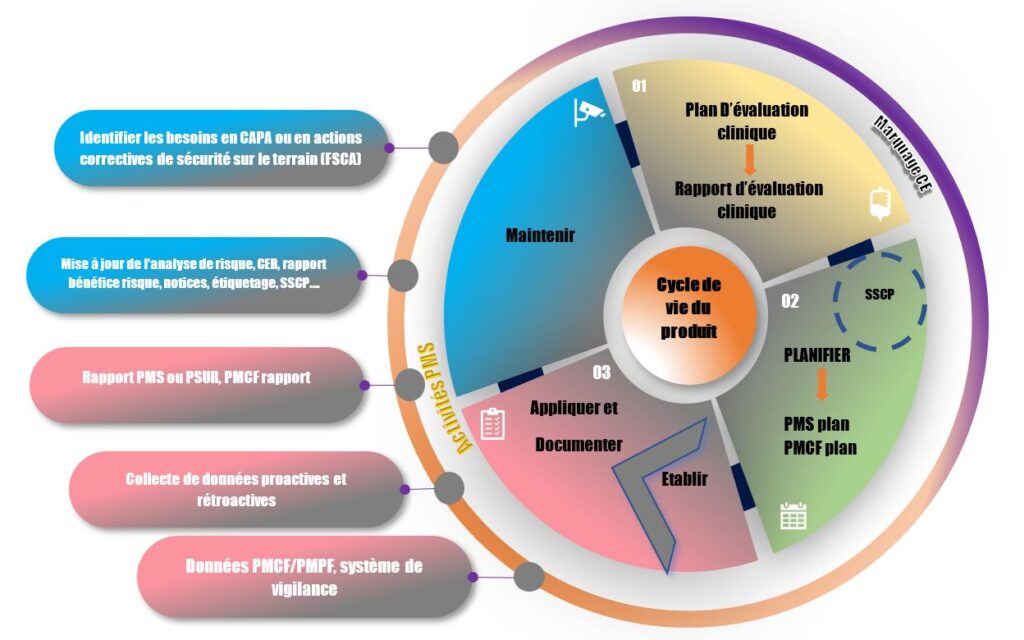
Pour tout DM (incluant les DMDIV) mis sur le marché, mis à disposition sur le marché ou mis en service, les fabricants conçoivent, établissent, documentent, appliquent, maintiennent et mettent en place un système de surveillance après commercialisation en fonction du risque et du type du Dispositif* concerné.
La collecte et l’analyse des données pertinentes sur la qualité, la performance et la sécurité du DM sont fondées sur un plan de surveillance après commercialisation.
Cette collecte se fait de manière active et systématique pendant toute la durée de vie du DM.
Les données d’entrée incluent notamment les réclamations, données de vigilance & analyses de tendance, réclamations, données de ventes, …
Le plan doit notamment inclure la méthodologie utilisée pour identifier toute augmentation statistiquement significative de la fréquence ou de la sévérité des incidents ainsi que la période d’observation. Aussi, la mise en place des courbes de tendance peut être un challenge pour les industriels.
Pour les DMs de classe I et les DMDIV de classe A et B, la synthèse des résultats et des conclusions de l’analyse des données collectées de surveillance après commercialisation est établie dans un rapport de surveillance après commercialisation. Le rapport est mis à jour selon les besoins, intégré dans la documentation technique et mis à la disposition de l’autorité compétente sur demande.
Pour les autres classes de DMs, la synthèse des résultats et des conclusions de l’analyse des données collectées de surveillance après commercialisation est établi dans un rapport périodique actualisé de sécurité (ou PSUR) intégré dans la documentation technique, mis à la disposition de l’organisme notifié et sur demande aux autorités compétentes. Pour les dispositifs de classe III, les dispositifs implantables, et les DMDIV de classe D, les fabricants communiqueront le PSUR via Eudamed et doivent pour le moment suivre les mesures transitoires (cf MDCG 2021-1)..
La surveillance après commercialisation est un outil essentiel pour garantir la performance et la sécurité des dispositifs.
Elle permet :
- D’actualiser la balance bénéfice risque et l’amélioration de l’analyse de risque
- D’actualiser les informations de conception et fabrication,
- D’actualiser la performance clinique
- D’actualiser Le résumé des caractéristiques de sécurité et des performances cliniques (RCSPC ou SSCP/SSP), la notice et étiquetage
- De faire apparaitre les besoins en actions préventives/correctives
- D’améliorer la facilité d’utilisation, les performances et de la sécurité du DM,
- De contribuer à la surveillance après commercialisation d’autres dispositifs,
- D’identifier les tendances
Suivi Clinique Après Commercialisation
Le suivi clinique après commercialisation (SCAC/PMCF/PMPF) fait partie intégrante de la surveillance après commercialisation. Le SCAC est une démarche proactive de collecte et d’évaluation de données cliniques/de performance résultant de l’utilisation d’un DM marqué CE, mis sur le marché ou mis en service conformément à sa destination. Le SCAC est un processus continu de mise à jour de l’évaluation clinique.
Les guides MDCG :
- MDCG-2020-7 : Guidance on PMCF plan Template et
- MDCG-2020-8 : Guidance on PMCF evaluation report template
présentent toutes les données nécessaires pour conduire un PMCF.
Comme le suivi après commercialisation, le SCAC a pour objectif de:
- Confirmer la sécurité et la performance du DMDIV,
- Identifier des effets indésirables (EI) non connus et suivre les EI et CI connus,
- Identifier et analyser des risques émergents,
- Vérifier l’acceptabilité du rapport Bénéfice/Risque de façon continue,
- Identifier les erreurs d’utilisations ou utilisations hors indications.
Notre intervention
L’arrivée du MDR et de l’IVDR ont renforcé de façon significative les exigences relatives à la surveillance après commercialisation. De nouveaux livrables sont demandés et font partie de la documentation technique à présenter à l’organisme notifié.
Dans ce contexte, où la demande de mise en conformité est forte et urgente, le groupe EFOR apporte son expertise et une approche méthodique à ses clients, fabricants de DM/DMDIV grâce à une équipe de profils spécialisés, qui pourront traiter le suivi après commercialisation de A à Z, depuis la mise en place du plan PMS jusqu’à la rédaction du rapport, tout en restant dans un travail collaboratif basé sur l’échange.
Nos équipes se tiennent à votre disposition pour répondre à vos questions et vous accompagner sur ces sujets
N’hésitez pas à les solliciter via le formulaire de contact
Le groupe
Nos engagements RSE
Conscients de notre responsabilité sociale et environnementale, nous agissons chaque jour pour faire avancer la société.
Nos actualités
Suivez toutes nos infos santé


