Les modifications des Dispositifs Médicaux (DM/ DMDIV)
20/10/2022

Une fois marqué CE
La vie d’un dispositif médical n’est pas un long fleuve tranquille… Qui n’a jamais assisté à une réunion d’équipe sur une modification à implémenter alors que le produit venait tout juste d’obtenir le marquage CE ? Modifier une spécification, ajouter un fournisseur, corriger une défaillance…tout cela et bien d’autres, font partie du cycle post marché.
Mais peut-on réaliser toute sorte de modifications ? Y a-t-il des règles à respecter ?
Modification substantielle
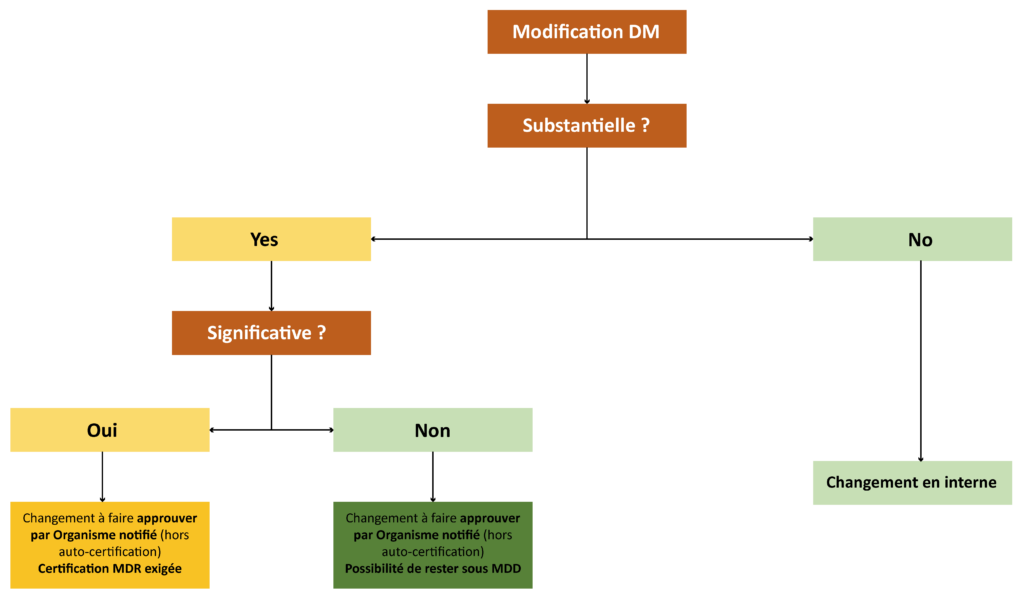
Avant la publication des Règlements (UE) 2017/745-746, les modifications des dispositifs médicaux (DM et DMDIV) certifiées selon les Directives 93/42/EEC et 98/69/EEC étaient traitées uniquement de manière binaire : substantielle ou non substantielle (parfois appelée majeure ou mineure). Pour faire simple, une modification est considérée comme substantielle si celle-ci impacte la sécurité et/ou l’efficacité et/ou la performance du produit. A noter que certaines modifications du Système de Management de la Qualité peuvent aussi être considérées comme substantielles.
Même si chaque modification reste sujet à discussion et interprétation, le guide NBOG 2014-3 permet de traiter au mieux cela et de conclure sur son statut. Dans le cas où la modification est définie comme substantielle, la demande d’implémentation du changement nécessite d’être soumise à l’organisme notifié qui a établi l’évaluation de conformité (excepté pour les dispositifs de classe I ou A en auto-certification). Il faudra alors démontrer que tout a été mis en œuvre pour conserver une balance bénéfice/risque favorable pour le patient.
Modification significative
Depuis la mise en application des Règlements (UE) 2017/745-746, un trait additionnel est apparu quant au statut d’une modification pour les dispositifs encore sous certification 93/42/EEC et 98/79/EEC (Legacy devices). Au-delà du caractère substantiel d’une modification, il faut désormais aussi évaluer si celle-ci est significative ou non. Dans un premier temps, les articles 120 du Règlement (UE) 2017/745 et 110 du Règlement (UE) 2017/746 définissaient ce statut comme étant une modification de conception ou de finalité. Le guide MDCG 2020-3 est venu clarifier tout cela et a rajouté des notions supplémentaires à prendre en compte pour les DM (changement du logiciel, des matériaux ou de la méthode de stérilisation). A l’aide d’arbres décisionnels, il permet ainsi de statuer sur cette nouvelle catégorie de modifications. Le MDCG 2022-6 est un guide équivalent pour les DMDIV.
Comme dans le cas d’un changement dit substantiel, si celui-ci est jugé significatif, il est obligatoire de soumettre la demande d’implémentation à l’organisme notifié en charge de la certification. L’impact devient alors conséquent. En effet, le dossier du produit devra être alors entièrement déposé selon les Règlements (UE) 2017/745-746 pour voir la modification traitée et acceptée. Ce qui impliquera une certification du dispositif DM/DIV sous les nouveaux règlements.
En résumé
L’arbre décisionnel ci-dessous permet d’illustrer le processus de maitrise du changement (couramment appelé Change Control), en particulier la chronologie des décisions à considérer lors de la modification d’un dispositif médical :
Le groupe Efor vous accompagne
Nos experts en affaires réglementaires, qualité et autres spécialités sauront vous proposer le support adapté à vos besoins sur toutes les thématiques suivantes (liste non exhaustive) :
- Evaluation et définition du statut de vos modifications,
- Accompagnement dans l’implémentation de vos changements ainsi que dans la mise à jour des dossiers techniques associés,
- Actualisation de votre Système de Management de la Qualité pour intégrer les différentes exigences pour la maitrise des changements selon la réglementation en vigueur.
N’hésitez pas à solliciter nos équipes via le formulaire de contact
Le groupe
Nos engagements RSE
Conscients de notre responsabilité sociale et environnementale, nous agissons chaque jour pour faire avancer la société.
Nos actualités
Suivez toutes nos infos santé


