DMDIV: la mise en œuvre progressive du règlement 2017/746
7/07/2022

Depuis le 26 Mai 2002, tous les DMDIV doivent être mis sur le marché européen selon le Règlement 2017/746 « relatif aux dispositifs médicaux de diagnostic in vitro et abrogeant la Directive 98/79/CE et la décision 2010/227/UE de la Commission ».
Le Règlement 2017/746 introduit des modifications importantes dans le domaine des dispositifs médicaux de diagnostic in vitro (DMDIV). Le Règlement vise à assurer le bon fonctionnement du marché intérieur ainsi qu’un haut niveau de protection de la santé publique, des patients et des utilisateurs.
L’un des principaux changements concerne l’intervention d’organismes indépendants d’évaluation de la conformité (les organismes notifiés). Sous la Directive 98/79/CE, seul un nombre relativement restreint de dispositifs à haut risque (environ 8 % de l’ensemble des DMDIV disponibles sur le marché) était soumis au contrôle des organismes notifiés. Au titre du Règlement, environ 80 % d’entre eux seront placés sous le contrôle des organismes notifiés, dont une vaste majorité pour la première fois.
Des dispositions transitoires pour les DMDIV marqués CE avant le 26/05/2022 sont présentées dans l’article 110 du Règlement 2017/746. Suite à la parution du Règlement 2022/112 , les périodes transitoires sont prolongées en fonction de la classe de risque du dispositif concerné. Elle sont plus courtes pour les dispositifs appartenant à une classe de risque élevée et plus longues pour les dispositifs appartenant à une classe de risque moins élevée.
Les durées des périodes de transition sont présentées ci-après :
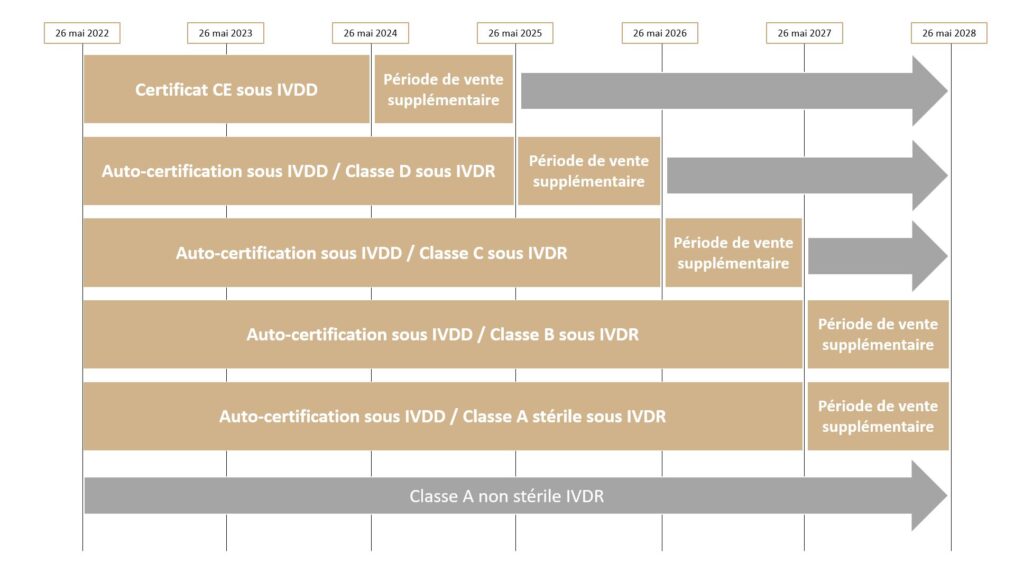
Les dispositifs de classe D et de classe C bénéficient respectivement d’une période de transition jusqu’en mai 2025 et mai 2026 tandis que les dispositifs de classe B et de classe A bénéficient d’une période de transition jusqu’en mai 2027.
Pour les dispositifs ne pouvant pas bénéficier de la période de transition, comme ceux de classe A et les nouveaux DMDIV, ceux-ci doivent être conformes au Règlement 2017/746 depuis le 26 Mai 2022.
Notre intervention
Depuis l’arrivée du Règlement 2017/746, de nouveaux livrables sont demandés et font partie de la documentation technique à présenter à l’organisme notifié (validité scientifique, plan et rapport d’évaluation des performances…).
Le groupe Efor apporte son expertise et une approche méthodique à ses clients, fabricants, importateurs et distributeurs de DMDIV, grâce à une équipe de profils spécialisés, qui pourront traiter la transition IVDR dans son entièreté.
Le groupe
Nos engagements RSE
Conscients de notre responsabilité sociale et environnementale, nous agissons chaque jour pour faire avancer la société.
Nos actualités
Suivez toutes nos infos santé


