Quel est le champ d'application de l'IEC 62304 ?
25/06/2020

Avec l’évolution des nouvelles technologies et le besoin de digitalisation de nos environnements, de plus en plus de Dispositifs Médicaux intègrent ou sont des logiciels. Le Règlement UE 2017/745 aborde cette thématique et pose un cadre pour ces types de dispositifs médicaux. Lors du développement d’un logiciel, la norme IEC 62304 est l’une des normes à appliquer puisqu’elle définit les exigences du cycle de vie pour le développement d’un logiciel médical et d’un logiciel intégré dans des dispositifs médicaux.
Quel est le champ d’application de l’IEC 62304 ?
La norme IEC 62304 : Logiciels de dispositifs médicaux – Processus du cycle de vie du logiciel, s’applique au développement et à la maintenance de tout logiciel étant un dispositif médical ou destiné à faire partie intégrante d’un dispositif médical.
Un logiciel est considéré comme dispositif médical si celui-ci est destiné à une ou plusieurs des fins médicales définies dans le RÈGLEMENT (UE) 2017/745 DU PARLEMENT EUROPÉEN ET DU CONSEIL.
Il est important de noter que tout logiciel n’ayant pas de finalité médicale comme les applications de sport ou de gestion de nutrition n’entre pas dans le cadre de la réglementation relative aux DM.
Cette norme ne couvre pas la validation et la libération finale du dispositif médical, même lorsque le dispositif est entièrement constitué de logiciels. En fonction de votre DM d’autres normes devront éventuellement être appliquées comme l’iec 82304 relative aux logiciels de santé (ne s’applique pas aux logiciels de santé destinés à devenir partie intégrante d’un matériel spécifique conçu pour une utilisation dans le domaine de la santé) ou encore la norme IEC 60601-1 relative aux appareils électro médicaux.
Application de l’IEC 62304 ?
Les processus abordés par la norme IEC 62304 sont présentés dans le schéma suivant :
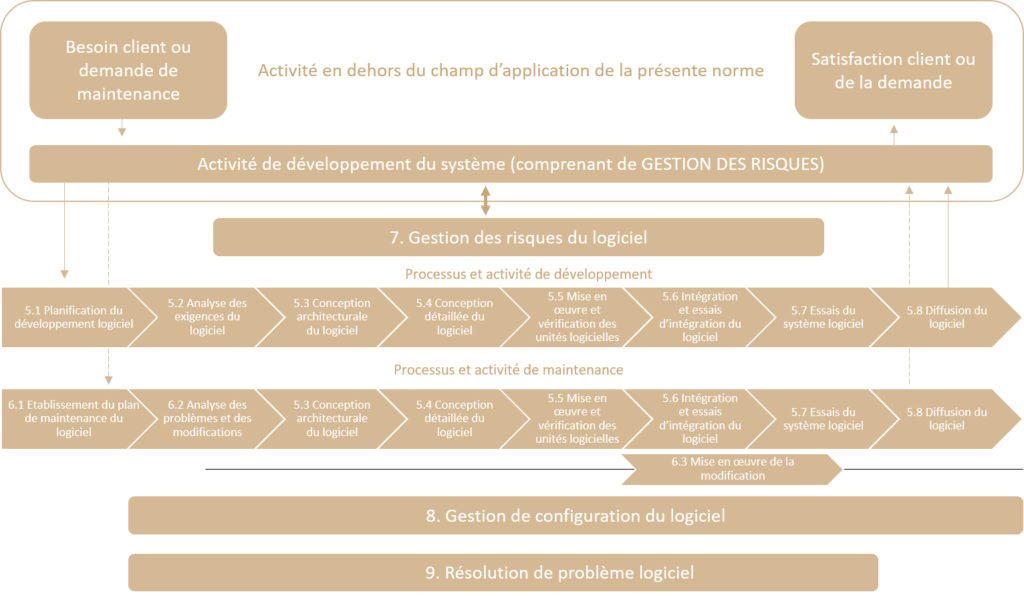
Pour appliquer la norme IEC 62304, il faut satisfaire aux exigences générales suivantes :
- Mise en place d’un système de management de la qualité (ISO 13485)
- Appliquer un processus de gestion des risques conforme à l’iso 14971
- Attribuer une classe de sécurité du logiciel
La norme IEC 62304 introduit trois classes de sécurité du logiciel, allant de A (moins critique) à C (plus critique), qui se définissent suivant la gravité des conséquences d’une défaillance du logiciel :
- Classe A : Aucune blessure ou atteinte à la santé n’est possible
- Classe B : Une blessure non-grave est possible
- Classe C : Le décès ou une blessure grave est possible
A noter que selon la classe du logiciel une partie (pour les logiciels de classes A et B) ou l’ensemble (pour les logiciels de classe C) des exigences de la norme IEC 62304 devront être mises en place (ou suivies).
Ces classes de sécurité du logiciel sont indépendantes des quatre classes concernant les dispositifs médicaux tels que définies par la Directive 93/42/CEE ou le Règlement UE 2017/745 (I, iia, iib et III).
La conformité à la norme passe par un développement basé sur une analyse des risques robustes et un système de traçabilité permettant d’assurer un suivi du dispositif tout au long du cycle de ce dernier.
L’application de la norme IEC 62304 permet de répondre aux exigences réglementaires applicables concernant la conception, le développement, la vérification et la maintenance des logiciels.
Si vous souhaitez obtenir plus d’informations concernant le contenu ou encore l’application de cette norme, nous sommes à votre écoute via le formulaire de contact
Pourquoi vous faire accompagner par EFOR?
Nos experts en affaires réglementaires sauront vous proposer un accompagnement de qualité sur toutes les thématiques suivantes :
- Réalisation de la veille réglementaire et normative pour identifier les règlementations et normes applicables à votre produit.
- Mise en conformité réglementaire de votre dispositif médical (logiciel ou dispositif médical intégrant un logiciel) lors de la phase de développement.
- Accompagnement dans la rédaction du dossier de conception du produit en adéquation avec les exigences des normes IEC 62304, ISO 14971, ISO 13485 et autres normes applicables.
- Rédaction du dossier technique du dispositif médical.
Nos experts digitaux quand à eux sauront vous proposer un accompagnement pour les activités techniques de vérification :
- Planification et gestion des essais de vérification
- Mise en œuvre et vérification des unités logicielles
- Intégration des unités logicielles et essai du logiciel intégré, incluant les essais de régression.
Le groupe
Nos engagements RSE
Conscients de notre responsabilité sociale et environnementale, nous agissons chaque jour pour faire avancer la société.
Nos actualités
Suivez toutes nos infos santé


